1, 微量元素分析仪有什么测定原理?

根据了解,有三大测定原理:原理1:极谱法在被测物质的溶液内,加以线性电压扫描(DC≤3V),利用检测到的被测物质的峰电流,根据Ip=KC(其中,Ip为峰电流,K为常数,C为待测物质浓度)进行定量分析,检验出待测物质的准确含量。原理2:微分电位溶出法在被测物质的溶液中,首先进行恒电势富集,将被测物质富集到工作电极上,然后断开恒电势富集,利用体系内的氧化剂(通常为溶解氧)将富集在工作电极上的被测物质氧化溶解至溶液中,同时记录溶出过程中的溶出曲线(dt/dE-E曲线),根据H=KC(其中,H为峰高;K为常数;C为被测物质浓度)进行定量分析,检测出被测物质的准确浓度。原理3:溶出伏安法在被测物质的溶液内,首先进行恒电势富集,将被测物质富集到工作电极上,然后断开富集电势同时加以线性电压扫描(DC≤3V),利用检测到的被测物质的峰电流,根据Ip=KC(其中,Ip为峰电流,K为常数,C为待测物质浓度)进行定量分析,检验出待测物质的准确含量。以上叙述仅供参考,希望能帮助到您……
2, 请问分光光度法测物质含量的原理及方法是什么?

分光光度计原理大致是采用一个可以产生多个波长的光源,通过系列分光装置,从而产生特定波长的光源,光线透过测试的样品后,部分光线被吸收,计算样品的吸光值,从而转化成样品的浓度。样品的吸光值与样品的浓度成正比。根据朗伯比尔定律单色光辐射穿过被测物质溶液时,被该物质吸收的量与该物质的浓度和液层的厚度(光路长度)成正比,其关系如下式:A=-lg(I/I。)=-lgT=kLc式中 :A 为吸光度;I。为入射的单色光强度;I 为透射的单色光强度;T 为物质的透射率;k 为摩尔吸收系数;L 为被分析物质的光程,即比色皿的边长c 为物质的浓度物质对光的选择性吸收波长,以及相应的吸收系数是该物质的物理常数。当已知某纯物质在一定条件下的吸收系数后可用同样条件将该供试品配成溶液,测定其吸收度,即可由上式计算出供试品中该物质的含量。在可见光区,除某些物质对光有吸收外,很多物质本身并没有吸收但可在一定条件下加入显色试剂或经过处理使其显色后再测定,故又称比色分析。由于显色时影响呈色深浅的因素较多,且常使用单色光纯度较差的仪器,故测定时应用标准品或对照品同时操作。
3, 分光光度法原理
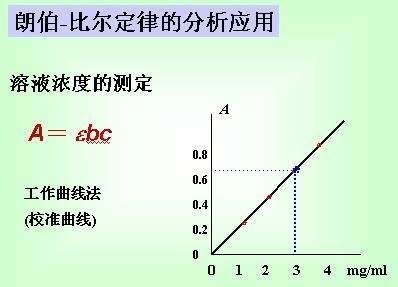
当一束强度为I0的单色光垂直照射某物质的溶液后,由于一部分光被体系吸收,因此透射光的强度降至I,则溶液的透光率T为: 根据朗伯(Lambert)-比尔(Beer)定律: A=abc 式中A为吸光度,b为溶液层厚度(cm),c为溶液的浓度(g/dm^3), a为吸光系数。其中吸光系数 与溶液的本性、温度以及波长等因素有关。溶液中其他组分(如溶剂等)对光的吸收可用空白液扣除。 由上式可知,当固定溶液层厚度l和吸光系数 时,吸光度A与溶液的浓度成线性关系。在定量分析时,首先需要测定溶液对不同波长光的吸收情况(吸收光谱),从中确定最大吸收波长 ,然后以此波长 的光为光源,测定一系列已知浓度c溶液的吸光度A,作出A~c工作曲线。在分析未知溶液时,根据测量的吸光度A,查工作曲线即可确定出相应的浓度。这便是分光光度法测量浓度的基本原理。
名词解释
溶液
溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质( 溶质)以分子或更小的质点分散于另一物质(溶剂)中。物质在 常温时有固体、液体和气体三种 状态。因此溶液也有三种状态,大气本身就是一种气体溶液, 固体溶液混合物常称固溶体,如合金。一般溶液只是专指液体溶液。液体溶液包括两种,即能够导电的 电解质溶液和不能导电的 非电解质溶液。所谓胶体溶液,更确切的说应称为 溶胶。其中,溶质相当于 分散质,溶剂相当于分散剂。在生活中常见的溶液有蔗糖溶液、碘酒、澄清石灰水、稀盐酸、盐水、空气等。
浓度
浓度,是一个汉语词语,意思是一定量的溶液中所含溶质的量。
光度
光度学是研究光强弱的学科。不同于辐射度量学,光度学把不同波长的辐射功率用光度函数加权;在天文学中,光度(luminosity)是物体每单位时间内辐射出的总能量,即辐射通量。
相关推荐
水质监测分析方法 水质检测的方法有哪些? 可见异物灯检法 灯检的检测方法 HPLC是测什么的 高效液相色谱仪是用来检测分析什么的呀? 光谱分析仪(FMC) 生物检测所 生物常用检测试剂有哪些


