1, 甲烷完全燃烧的化学方程式为

甲烷燃烧的化学方程式:甲烷燃烧因为区分完全燃烧和不完全燃烧两种情况。CH₄+2O₂=CO₂+2H₂O(完全燃烧生成CO₂和水)2CH₄+3O₂=2CO+4H₂O(不完全燃烧时生成CO和水)甲烷主要是作为燃料,如天然气和煤气,广泛应用于民用和工业中。作为化工原料,可以用来生产乙炔 、氢气、合成氨、碳黑、硝氯基甲烷、二硫化碳、一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氢氰酸等。以氯化为例:可以看到试管内氯气的黄绿色气体逐渐变淡,有白雾生成,试管内壁上有油状液滴生成,这是甲烷和氯气反应的所生成的一氯甲烷、二氯甲烷、氯仿(或三氯甲烷)、四氯化碳(或四氯甲烷)、氯化氢和少量的乙烷(杂质)的混合物。CH₄+Cl₂→(光照)CH₃Cl(气体)+HClCH₃Cl+Cl₂→(光照)CH₂Cl₂(油状物)+HClCH₂Cl₂+Cl₂→(光照)CHCl₃(油状物)+HClCHCl₃+Cl₂→(光照)CCl₄(油状物)+HCl在隔绝空气并加热至1000℃的条件下,甲烷分解生成炭黑和氢气CH₄=(1000℃)=C+2H₂氢气是合成氨及汽油等工业的原料;炭黑是橡胶工业的原料。参考资料来源:搜狗百科——甲烷
2, 甲烷与CO的燃烧问题

CaCl2吸收的是H2O只有甲烷燃烧能产生H2OCH4 +2 O2 = CO2 + 2 H2O16 44 36x y 72 g解得x = 32 g,y = 88 g所以混合物中甲烷的质量是32 g混合气体的成分包括:产生的H2O、CO燃烧产生的CO2、CH4燃烧产生的CO2所以CO燃烧产生的CO2 = 204 - 72 - 88 = 44 g2 CO + O2 = 2 CO256 88z 44 gz = 28 g所以混合物中CO的质量是28 g即原混合气体中甲烷、CO的质量分别是32 g、28 g
3, ch4燃烧的化学方程式什么反应
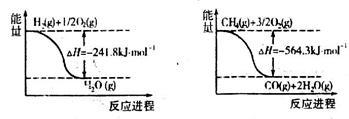
甲烷、一氧化碳在空气中燃烧时都是蓝色火焰。由于燃烧一般采用的是玻璃导管,所以,看见的火焰颜色是黄色的,这是因为玻璃管中含有钠元素,钠的焰色反应为黄色,火会烧到玻璃管发出黄色,黄色掩盖了蓝色。一氧化碳燃烧产生蓝色火焰生,生成能使澄清的石灰水变浑浊的气体;2CO+O₂=CO₂(条件:点燃)甲烷燃烧产生明亮的蓝色火焰,火焰上方的烧杯中有水珠出现,同时生成能使澄清石灰水变浑浊的气体。CH₄+2O₂=CO₂+2H₂O(条件:点燃)通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。但是在特定条件下,甲烷也会发生某些反应。点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。说明甲烷燃烧生成水和二氧化碳。把甲烷气体收集在高玻璃筒内,直立在桌上,移去玻璃片,迅速把放有燃烧着的蜡烛的燃烧匙伸入筒内,烛火立即熄灭,但瓶口有甲烷在燃烧,发出淡蓝色的火焰。这说明甲烷可以在空气里安静地燃烧,但不助燃。把玻璃导管口放出的甲烷点燃,把它放入贮满氯气的瓶中,甲烷将继续燃烧,发出红黄色的火焰,同时看到有黑烟和白雾。黑烟是炭黑,白雾是氯化氢气体和水蒸气形成的盐酸雾滴。一氧化碳燃烧时发出蓝色的火焰,放出大量的热。因此一氧化碳可以作为气体燃料。实验室一般使用浓硫酸催化或加热草酸分解并用氢氧化钠除掉二氧化碳制得一氧化碳。参考资料来源:搜狗百科——甲烷参考资料来源:搜狗百科——一氧化碳
名词解释
CO
钴[gǔ],元素符号Co,银白色铁磁性金属,表面呈银白略带淡粉色,在周期表中位于第4周期、第Ⅷ族,原子序数27,原子量58.9332,密排六方晶体,常见化合价为+2、+3。 钴是具有光泽的钢灰色金属,比较硬而脆,有铁磁性,加热到1150℃时磁性消失。钴的化合价为+2价和+3价。在常温下不和水作用,在潮湿的空气中也很稳定。在空气中加热至300℃以上时氧化生成CoO,在白热时燃烧成Co3O4。氢还原法制成的细金属钴粉在空气中能自燃生成氧化钴。钴是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料。 2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,钴和钴化合物在2B类致癌物清单中。
CO2
二氧化碳(carbon dioxide)是一种碳氧化合物,是空气中常见的化合物。常压下为无色、无味、不助燃、不可燃。略溶于水中,形成碳酸,碳酸是一种弱酸。 二氧化碳一般可由高温煅烧石灰石或由石灰石和稀盐酸反应制得,主要应用于冷藏易腐败的食品(固态)、作致冷剂(液态)、制造碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。研究表明:低浓度的二氧化碳没有毒性,高浓度的二氧化碳则会使动物中毒。
44
44(四十四)是43与45之间的自然数、合数。