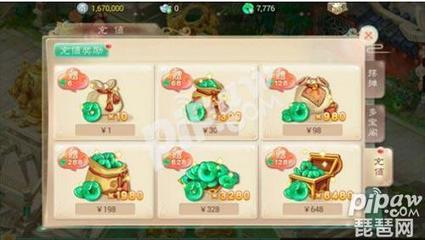
2, 【化学】求各种难溶解电解质的Ksp(溶度积)表

名称 化学式 Ksp 氯化银 AgCl 1.56*10^-10 氢氧化铁 Fe(OH)3 1.1*10^-36 溴化银 AgBr 7.7*10^-13 硫化铁 FeS 3.7*10^-19 碘化银 AgI 1.5*10^-16 氯化亚汞 Hg2Cl2 2*10^-18 铬酸银 Ag2CrO4 9.0*10^-12 溴化亚汞 Hg2Br2 1.3*10^-21 碳酸钡 BaCO3 8.1*10^-9 碘化亚汞 Hg2I2 1.2*10^-28 铬酸钡 BaCrO4 1.6*10^-10 硫化汞 HgS 4*10^-53~2*10^-49 硫酸钡 BaSO4 1.08*10^-10 碳酸锂 Li2CO3 1.7*10^-3 碳酸钙 CaCO3 8.7*10^-9 碳酸镁 MgCO3 2.6*10^-5 草酸钙 CaC2O4 2.57*10^-9 氢氧化镁 Mg(OH)2 1.2*10^-11 氟化钙 CaF2 3.95*10^-11 氢氧化锰 Mn(OH)2 4*10^-14 硫酸钙 CaSO4 1.96*10^-4 硫化锰 MnS 1.4*10^-15 硫化镉 CdS 3.6*10^-29 碳酸铅 PbCO3 3.3*10^-14 硫化铜 CuS 8.5*10^-45 铬酸铅 PbCrO4 1.77*10^-14 硫化亚铜 Cu2S 2*10^-47 碘化铅 PbI2 1.39*10^-8 氯化亚铜 CuCl 1.02*10^-6 硫酸铅 PbSO4 1.06*10^-3 溴化亚铜 CuBr 4.15*10^-8 硫化铅 PbS 3.4*10^-28 碘化亚铜 CuI 5.06*10^-12 氢氧化锌 Zn(OH)2 1.8*10^-14 氢氧化亚铁 Fe(OH)2 1.64*10^-14 硫化锌 ZnS 1.2*10^-23
3, 硫酸铅的ksp是多少?
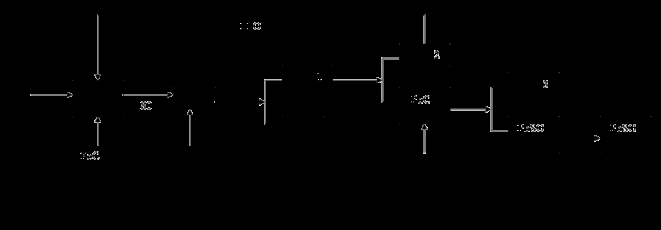
解:(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;由流程图可知,操作a是把溶液与不溶物分离,应是过滤;故答案为:增大接触面积,提高浸取率;过滤;(2)Ksp[Al(OH)3]=c(Al3+)•c3(OH-)=1.3*10-33,水解平衡常数Kh=c3(H+) /c(Al3+) ,故Ksp[Al(OH)3]•Kh=(kw)3=(10-14)3=10-42,所以Kh=10-42 /1.3*10-33 =7.7*10-10;故答案为:7.7*10-10;(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;故答案为:2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3.
5, 铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教...
铬酸钡,铬酸铅,铬酸银都能被硝酸溶解。铬酸根和重铬酸根在溶液中,随着溶液酸碱性的改变会相互转化,酸性溶液中以重铬酸根形式存在,碱性溶液中以铬酸根形式存在。在酸性溶液中,不溶于水的铬酸盐能转化成重铬酸根进入溶液,迫使铬酸盐沉淀逐渐溶解。反应如下:铬酸钡的微弱电离:2BaCrO4——2Ba2+ + 2 CrO4 2-+14 H+II CrO4 2-的转化: Cr2O7 2-+7H2O 生成难以电离的H2O由于铬酸根的逐渐转化,迫使铬酸钡继续电离,直至完全溶解。
名词解释
10
10,相当于汉字\"十\"。是位于9与11之间的自然数、正整数。 在十进制中,10是最小的两位数,写法是一个1后面加一个0,是一个合数,有4个因数(约数),是一个有理数。
OH
OH也就是氢氧根,在无机化学中,可以与金属离子或铵根离子化合成碱、碱式盐。
14
14,为阿拉伯数字第十四位,是介于13到15的自然数。在南美洲国家,14这个数字被当作吉祥数。